Contoh Soal Bentuk molekul
Contoh Soal Bentuk molekul - Bentuk molekul berhubungan dengan posisi atom-atom dalam molekul. Dalam hal ini, bentuk molekul menggambarkan posisi atom-atom dalam ruang tiga dimensi dan besarnya sudut ikatan yang terjadi pada ikatan kovalen dalam suatu molekul.
Bentuk-bentuk molekul dapat dijelaskan dengan berbagai pendekatan di antaranya teori VSEPR dan teori hibridisasi orbital atom. Berikut ini ulasannya.
A. Teori Hibridisasi Atom
Ikatan kimia melibatkan elektron valensi dan elektron yang menempati orbital dengan bentuk tertentu. Dalam hal ini, orbital menyatakan keadaan energi yang sebenarnya dari suatu atom yang terikat pada inti. Keadaan energi tersebut berubah ketika sebuah atom berikatan dengan atom yang lain. Keadaan orbital suatu atom dapat digunakan untuk meramalkan bentuk molekul. Menurut Pauling, orbital-orbital elektron valensi dapat membentuk serangkaian orbital yang disebut orbital atom hibrida atau orbital hibrida. Proses pembentukan orbital hibrida yang dilakukan oleh suatu atom disebut hibridisasi. Pada tingkatan ini akan dipelajari lima buah orbital hibrida.
1.Orbital hibrida sp2
Energi elektron valensi untuk atom periode dua terdapat pada orbital 2s dan 2p. Jika dua buah orbital 2p digabungkan dengan sebuah orbital 2s maka akan diperoleh tiga orbital hibridisasi sp2.
Contoh
Pembentukan molekul BF3
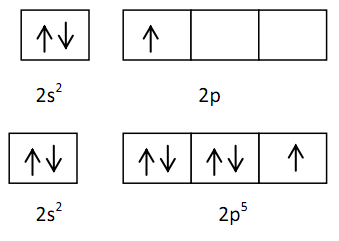
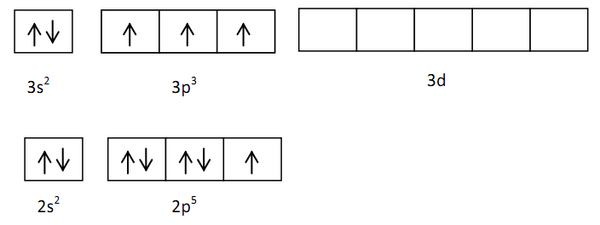
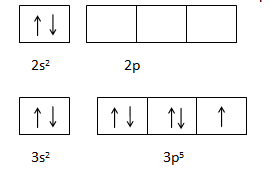
Molekul BF3 terdiri dari sebuah satu atom B dan tiga atom F. Konfigurasi elektron masing-masing akan ditunjukkan seperti berikut.
5B = 1s2 2s2 2p3 (3EV)
9F = 1s2 2s2 2p5 (7EV)
Diagram orbitalnya pada keadaan dasar sebagai berikut.
Energi elektron valensi untuk atom periode dua terdapat pada orbital 2s dan 2p. Jika dua buah orbital 2p digabungkan dengan sebuah orbital 2s maka akan diperoleh tiga orbital hibridisasi sp2.
Contoh
Pembentukan molekul BF3
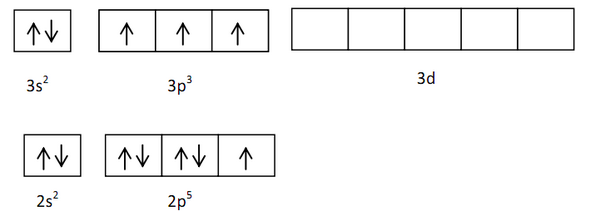
Molekul BF3 terdiri dari sebuah satu atom B dan tiga atom F. Konfigurasi elektron masing-masing akan ditunjukkan seperti berikut.
5B = 1s2 2s2 2p3 (3EV)
9F = 1s2 2s2 2p5 (7EV)
Diagram orbitalnya pada keadaan dasar sebagai berikut.

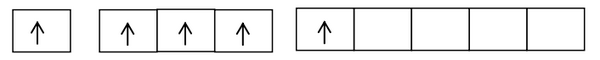
Berdasarkan konfigurasi ini, elektron valensi atom B pada orbital 2s telah berpasangan. Jika atom B akan berikatan dengan tiga atom F maka sebuah elektron atom B pada orbital 2s harus berpindah ke orbital p yang masih kosong.
2.Orbital Hibrida sp3
Jika orbital 2s digabungkan dengan tiga orbital 2p akan dihasilkan empat buah orbital terhibridisasi sp3.
Contoh
Pembentukan molekul CH4
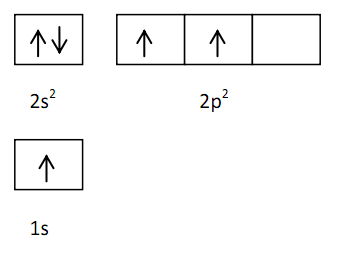
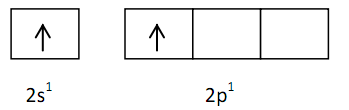
Molekul CH4 terdiri dari satu atom C dan empat atom H dengan konfigurasi sebagai berikut.
6C = 1s2 2s2 sp2 (4EV)
1H = 1s1 (1EV)
Diagram orbital untuk atom C dan H.
Jika orbital 2s digabungkan dengan tiga orbital 2p akan dihasilkan empat buah orbital terhibridisasi sp3.
Contoh
Pembentukan molekul CH4
Molekul CH4 terdiri dari satu atom C dan empat atom H dengan konfigurasi sebagai berikut.
6C = 1s2 2s2 sp2 (4EV)
1H = 1s1 (1EV)
Diagram orbital untuk atom C dan H.

Berdasarkan konfigurasi tersebut, elektron valensi atom C pada orbital 2s telah berpasangan. Jika atom C akan berikatan dengan empat atom H, maka satu elektron atom C pada orbital 2s harus pindah ke orbital 2p yang masih kosong.

Kemudian, orbital baru tersebut akan berikatan dengan atom H menjadi hibridisasi sp3.

3.Orbital dsp3
Jika sebuah orbital 3s digabungkan dengan tiga orbital 3p dan satu orbital 3d, maka akan diperoleh lima orbital hibridisasi dsp3.
Contoh
Molekul SF4 terdiri dari sebuah atom S dan empat atom F dengan konfigurasi sebagai berikut,
16S = 1s2 2s2 2p6 3s2 3p4
9F = 1s2 2s2 2p3
Diagram Orbital
Jika sebuah orbital 3s digabungkan dengan tiga orbital 3p dan satu orbital 3d, maka akan diperoleh lima orbital hibridisasi dsp3.
Contoh
Molekul SF4 terdiri dari sebuah atom S dan empat atom F dengan konfigurasi sebagai berikut,
16S = 1s2 2s2 2p6 3s2 3p4
9F = 1s2 2s2 2p3
Diagram Orbital

Berdasarkan konfigurasi tersebut, elektron valensi atom S pada orbital 2s telah berpasangan. Jika atom S akan berikatan dengan empat atom F, maka satu elektron atom S pada orbital 3s harus pindah ke orbital 3d yang masih kosong.

Elektron-elektron pada orbital baru tersebut akan berikatan dengan empat atom F pada orbital 3p, 3s dan 3d. Hibridisasi tersebut dinamakan dsp3.

4.Orbital Hibrida d2sp3
Jika sebuah orbital 3s digabungkan dengan 3 buah orbital 3p dan dua buah orbital 3d maka akan diperoleh enam buah orbital terhibridisasi d2sp3.
Contoh
Pembentukan molekul SF6.
Molekul SF6 terdiri dari sebuah atom S dan enam atom F dengan konfigurasi sebagai berikut.
16S = 1s2 2s2 2p6 3s2 3p4
9F = 1s2 2s2 2p3
Diagram Orbital
Jika sebuah orbital 3s digabungkan dengan 3 buah orbital 3p dan dua buah orbital 3d maka akan diperoleh enam buah orbital terhibridisasi d2sp3.
Contoh
Pembentukan molekul SF6.
Molekul SF6 terdiri dari sebuah atom S dan enam atom F dengan konfigurasi sebagai berikut.
16S = 1s2 2s2 2p6 3s2 3p4
9F = 1s2 2s2 2p3
Diagram Orbital

Berdasarkan konfigurasi tersebut, elektron valensi atom S pada orbital 3s dan 3p telah berpasangan. Jika atom S akan berikatan dengan enam atom F, maka satu elektron atom S pada orbital 3s dan satu elektron orbital 3p harus pindah ke orbital 3d yang masih kosong.

Elektron-elektron pada orbital baru tersebut akan berikatan dengan enam atom F pada orbital 3p, 3s, dan 3d. Hibridisasi tersebut dinamakan d2sp3.

5.Orbital hibrida
Orbital hibrida sp merupakan keadaan elektron dalam suatu atom saat atom tersebut terikat dengan atom-atom lain dimana keadaan elektron ini berada pada orbital s dan p.
Contoh
Pembentukan molekul BeCl2 Molekul BeCl2 terdiri dari sebuah atom Be dan dua atom Cl.
Orbital hibrida sp merupakan keadaan elektron dalam suatu atom saat atom tersebut terikat dengan atom-atom lain dimana keadaan elektron ini berada pada orbital s dan p.
Contoh
Pembentukan molekul BeCl2 Molekul BeCl2 terdiri dari sebuah atom Be dan dua atom Cl.
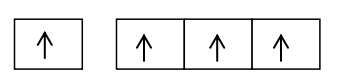
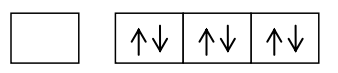
4Be = 1s2 2s2 (2 EV)
17Cl = 1s2 2s2 2p6 3s23p5 (7EV)
Diagram orbital untuk EV Be dan Cl pada keadaan dasar digambarkan
17Cl = 1s2 2s2 2p6 3s23p5 (7EV)
Diagram orbital untuk EV Be dan Cl pada keadaan dasar digambarkan

Berdasarkan konfigurasi di atas, elektron valensi atom Be pada orbital 2s telah berpasangan. Jika atom Be akan membentuk ikatan dengan dua atom Cl, maka satu elektron atom Be pada orbital 2s akan berpindah ke orbital 2p yang masih kosong.

Elektron-elektron tersebut akan berpasangan dengan elektron pada atom Cl yang ada pada orbital 2s dan 2p sehingga dinamakan hibrida sp.
Hibridisasi dengan Pasangan Elektron Bebas
Di antara orbital-orbital terhibridisasi sp, sp2, sp3, dsp3, dan d2sp3, satu di antara orbital-orbitalnya dapat ditempati oleh sepasang atau dua pasang elektron bebas. Hal ini akan mempengaruhi bentuk molekulnya. Sebagai contoh, atom C, N, dan O dalam molekul CH4 tidak mempunyai pasangan elektron bebas, sehingga mempunyai bentuk tetrahedron. Akan tetapi NH3 mempunyai satu pasangan elektron bebas yang berbentuk segitiga piramida dan H2O mempunyai dua pasang elektron bebas yang berbentuk bengkok (huruf V).
Di antara orbital-orbital terhibridisasi sp, sp2, sp3, dsp3, dan d2sp3, satu di antara orbital-orbitalnya dapat ditempati oleh sepasang atau dua pasang elektron bebas. Hal ini akan mempengaruhi bentuk molekulnya. Sebagai contoh, atom C, N, dan O dalam molekul CH4 tidak mempunyai pasangan elektron bebas, sehingga mempunyai bentuk tetrahedron. Akan tetapi NH3 mempunyai satu pasangan elektron bebas yang berbentuk segitiga piramida dan H2O mempunyai dua pasang elektron bebas yang berbentuk bengkok (huruf V).
B. Teori VSEPR atau Teori Domain Elektron
Teori VSEPR dapat digunakan untuk meramalkan bentuk suatu molekul. Untuk meramalkan bentuk suatu molekul dengan teori ini, kita harus menghitung jumlah pasangan elektron ikatan dan pasangan elektron bebas. Jumlah total pasangan elektron tersebut dinamakan bilangan sterik (SN).
Rumus Sterik
SN = m + n
dengan m = banyaknya atom ; dan n = pasangan elektron bebas
dengan m = banyaknya atom ; dan n = pasangan elektron bebas
Teori VSEPR dapat digunakan untuk meramalkan bentuk molekul karena memuat bilangan sterik. Jika X adalah atom yang terikat pada A (dalam ikatan tunggal, rangkap dua atau rangkap tiga) maka molekul yang dibentuk oleh atom-atom ini dapat dinyatakan dengan AXmEn
Rumus ini dapat digunakan untuk meramalkan geometri molekul tersebut.
Contoh:
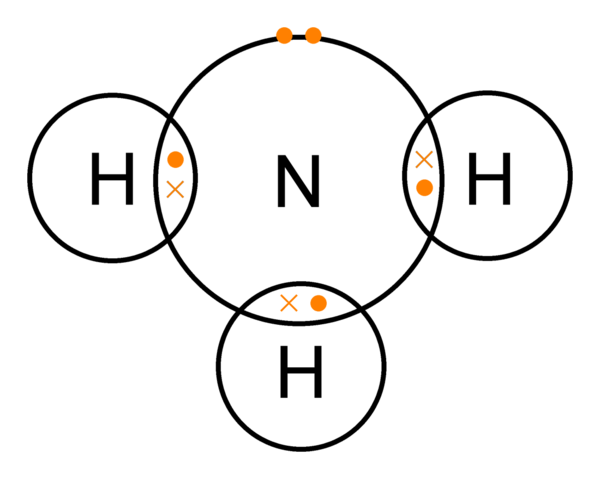
Molekul NH3 terdiri dari 3 atom H dan satu atom N dan digambarkan dengan struktur Lewis.
Rumus ini dapat digunakan untuk meramalkan geometri molekul tersebut.
Contoh:
Molekul NH3 terdiri dari 3 atom H dan satu atom N dan digambarkan dengan struktur Lewis.

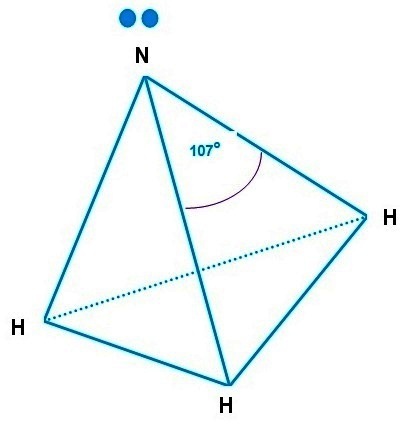
Berdasarkan bilangan steriknya, pasangan elektron pada molekul NH3 terdapat di dalam ruang tetrahedral. Akan tetapi karena molekul tersebut memiliki satu pasangan elektron bebas, maka bentuk molekulnya adalah segitiga piramida dan sudut ikatannya lebih sempit dari bentuk tetrahedral sempurna, yaitu 107o. Hal ini karena gaya tolak pasangan elektron bebasnya lebih kuat dari pasangan elektron ikatan. Oleh karena itu, bentuk molekul NH3 dapat digambarkan sebagai berikut.

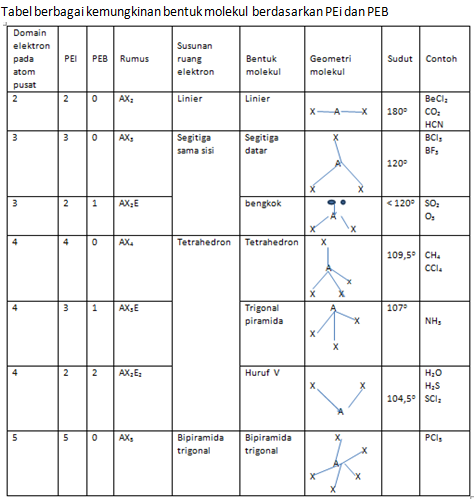
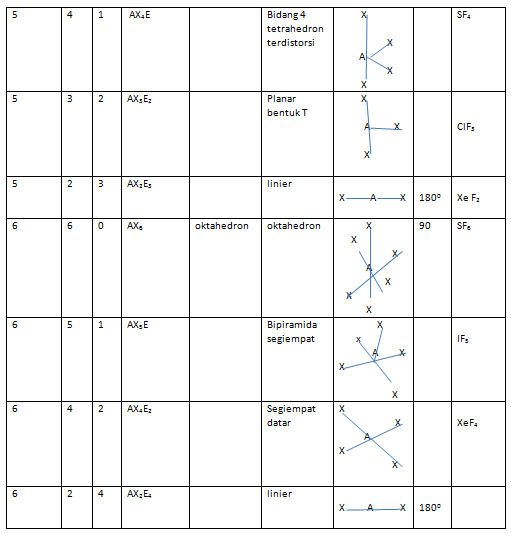
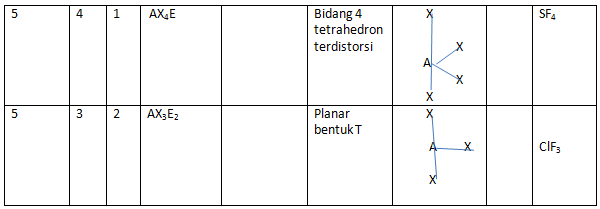
Berikut ini akan disajikan tabel bentuk molekul berbagai senyawa.



S1
Bentuk molekul dapat diramalkan dengan teori....
S2
Jumlah total PEI dan PEB dalam atom pusat disebut sebagai....
S3
Molekul BeCl2 memiliki dua pasang PEI dan tidak mempunyai PEB. Bentuk molekulnya adalah....
S4
Atom N dapat berikatan dengan tiga atom H membentuk molekul NH3 dengan sudut ikatan....
S5
Suatu orbital elektron valensi dapat membentuk serangkaian orbital baru yang disebut sebagai....
S6
Dalam pembentukan orbital hibrida molekul CH4, akan ada perpindahan elektron dari orbital… ke ....
S7
Atom S dengan elektron valensi 6 akan mengikat enam atom F dengan jenis orbital hibrida....
S8
Atom B dengan elektron valensi 3 berikatan dengan tiga atom F yang berorbital hibrida sp2. Bentuk molekul BF3 adalah....
S9
Orbital hibrida sp3, terjadi pada molekul....
S10
Dalam molekul H2O terdapat empat pasang elektron di sekitar atom pusat, tetapi bentuk molekul H2O bukan tetrahedron melainkan bengkok. Hal ini disebabkan adanya pengaruh….


Posting Komentar untuk "Contoh Soal Bentuk molekul"