Oksida dan Hidroksida dari Logam Alkali Tanah
Oksida
Seperti yang dijelaskan sebelumnya dalam postingan Logam Alkali Tanah sebelumnya bahwa logam golongan alkali tanah akan terbakar diudara menghasilkan oksida normal, kecuali anggota grup alkali tanah yang memiliki massa jenis yang paling rendah yaitu barium, yang juga membentuk oksida yaitu batiom peroksida. Magnesium oksida tidak larut dalam air, tetapi oksida logam lain malah bereaksi dengan air memeberikan senyawa logam alkali tanah hidroksida. Sebagai contoh, strontium oksida membentuk strontium hidroksida jika bereaksi denga air. Persamaan reaksinya adalah sebagai berikut :
SrO(s) + H2O(l)  Sr(OH)2(s)
Sr(OH)2(s)
Magnesium oksida mempunyai titik leleh yang tinggi yitu 2825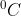 , sehingga senyawa logam ini sangat penting dalam industri pembuatan tunggu sebagai pelapisnya. Material senyawa ini juga dikenal dengan senyawa yang tanah panas (refractory coumpounds). Kristal magnesium oksida adalah senyawa yang tidak biasa, karena sangat baik dalam menghantarkan panas tetapi sangat jelek dalam menghantarkan listrik, walaupun di suhu yang tinggi. Ini adalah kombinasi dari sifat sifat zat yang sangat berperan penting dalam industri kompor listrik. Karena jika logam alin yang digunakan sebagai bahan kompor listrik, karena bersifat konduktor listrik yang baik, tentu akan sangat berbahaya dalam penggunaan sehari hari. Material ini menghantarkan panas dengan sangat cepat dari sumber panas ke bahan logam dalam wadah yang digunakan untuk memasak tanpa menghantarkan listrik ke bahan logam logam tersebut.
, sehingga senyawa logam ini sangat penting dalam industri pembuatan tunggu sebagai pelapisnya. Material senyawa ini juga dikenal dengan senyawa yang tanah panas (refractory coumpounds). Kristal magnesium oksida adalah senyawa yang tidak biasa, karena sangat baik dalam menghantarkan panas tetapi sangat jelek dalam menghantarkan listrik, walaupun di suhu yang tinggi. Ini adalah kombinasi dari sifat sifat zat yang sangat berperan penting dalam industri kompor listrik. Karena jika logam alin yang digunakan sebagai bahan kompor listrik, karena bersifat konduktor listrik yang baik, tentu akan sangat berbahaya dalam penggunaan sehari hari. Material ini menghantarkan panas dengan sangat cepat dari sumber panas ke bahan logam dalam wadah yang digunakan untuk memasak tanpa menghantarkan listrik ke bahan logam logam tersebut.
Calsium oksida, biasanya disebut kapur mentah, diproduksi dalam jumlag yang sangat besar terutama untuk industri baja. Oksida ini terbentuk dari pemanasan calsium karbonat pada suhu tinngi (1179 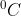 ) sesuai dengan persamaan reaksi :
) sesuai dengan persamaan reaksi :
CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g)
Calsium oksida adalah senyawa padat dengan titik leleh yang tinggi. Sifat ini sangat tidak biasa, ketika diarahkan pada sejumlah senyawa calsium oksida , senyawa akan berkilauan menghasilkan warna pustih yang terang. Fenomena ini disebut termoluminesence. Sebelum mengenal cahaya lampu yang dihasilkan oleh listrik, industri teater menggunakan oksida ini untuk menghasilkan cahaya dipentas.
Kalsium oksida bereakdi dengan air membentuk kalsium hidroksida, produk ini disebut juga kapur hidrat.
CaO(s) + H2O(l)  Ca(OH)2 (s)
Ca(OH)2 (s)
Kapur hidrat ini kadang kadang digunakan pada kebun untuk menetralisasi asam dalam tanah. Tapi bagaimanapun ini bukanlah langkah yang bijak karena melakukan ini akan menghasilkan kalsium hidroksida yang banyak sehingga meneybabkan tanah terlalu basa .
Ca(OH)2(s) + 2H+(aq)  Ca2+(aq) + 2H2O(l)
Ca2+(aq) + 2H2O(l)
Bubuk kapur bisa digunakan karena lebih aman dibandingkan kapur hidrat untuk agen menetrlisasikan tanah.
CaCO3(s) + 2H+(aq)  Ca2+(aq) + CO2(g) + H2O(l)
Ca2+(aq) + CO2(g) + H2O(l)
Hidroksida
Walaupun magnesium oksida hampir sempurna tidak larut didalam air, kalsium dan strontium oksida jauh lebih larut salam air, dan barium hidroksida sangat larut.
Perhatiakanlah abel kelarutan hidroksida alkali tanah berikut ini :
Keridaklarutan magnesium hidroksida ini menjadikan nya senyawa penting dalam kehidupan, yaitu sebagai obat maag yaitu antacid. Untuk menetralkan kelebihan asam yang dihasilkan dilambung seseorang harus mengkonsumsi ion hidroksida. Larutan ion hidroksida sangatkah korosif dan dan dapat menyebabkan penyakit yang lebih parah seperti terbakarnya dinding lambung. Untuk mengatasi hal ini digunakalah padatan magnesium hidroksida yang bercampur dalam air membentuk bubur yang dinamakan "milk of magnesia". Rendahnya kelarutan dari magensium hidroksida mengakibatkan hanya sedikit ion hidroksida yand ada dalam bubur magnesia tadi. Hal ini tentunya tidak terlalu berbahaya bagi kesehatan. Ketika senyawa tersebut memasuki lambung, magnesium hidroksida melalaui ion hidroksida menetralskan kelebihan asam klorida dalam lambung.
Reaksi yang terjadi :
Mg(OH)2 + 2H+  Mg2+(aq) + 2H2O(l)
Mg2+(aq) + 2H2O(l)
Larutan jenuh dari kalisum hidroksida mengacu pada air kapur. Larutan ini salah satu yang menegaskan bahwa test sederhana untuk karbon dioksida. Membuat gelembung gas melewati larutan calsium hidroksida pertama akan memberikan endapan putih dari calsium karbonat. Dilajutkan dengan melewatkan karon dioksida kepada larutan menyebabkan endapan menghilang dalam larutan kalsium karbonat.
Reaksinya :
Ca(OH)2(aq) + CO2(g)  CaCO3(s) + H2O(l)
CaCO3(s) + H2O(l)
CaCO3(s) + H2O(l) + CO2(g)  Ca(HCO3)3(aq)
Ca(HCO3)3(aq)
Pengirim Viki Satria


Posting Komentar untuk "Oksida dan Hidroksida dari Logam Alkali Tanah"