Cara Menentukan Perubahan Entalpi Reaksi Berdasarkan Tabel Entalpi Pembentukan Standar
Bagaimana kita bisa menentukan perubahan entalpi reaksi atau kalor reaksi menggunakan tabel entalpi pembentukan standar? Cara ini dapat kita lakukan jika data entalpi pembentukan standar rekatan dan produknya diketahui.
Secara umum jika terjadi rekasi :
mA + nB  oC + pD
oC + pD
Maka :
ΔH = {o x ΔH0f C + p ΔH0f D} – {m x ΔH0f A + n ΔH0f B}
Atau :
ΔH = { ∑ ΔH0f Produk} – {∑ ΔH0f Reaktan}
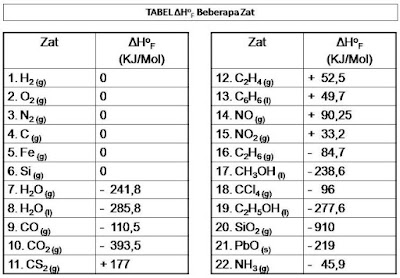
Berikut saya sajikan tabel entalpi pembentukan standar beberapa senyawa sebagai berikut :
Contoh soal dan Pembahasan
Soal 1
Tentukanlah perubahan entalpi reaksi berikut (ΔH0f dapat dilihat pada tabel diatas)
a. 2C2H6(g) + 7O2(g)  4CO2(g) + 6H2O(g)
4CO2(g) + 6H2O(g)
b. C3H8(g) + 5O2(g)  3CO2(g) + 4H2O(l)
3CO2(g) + 4H2O(l)
Pembahasan :
Reaks a
2C2H6(g) + 7O2(g)  4CO2(g) + 6H2O(g)
4CO2(g) + 6H2O(g)
Berdasarkan tabel entalpi pemebntukan standar diatas, didapatkan :
ΔH0f C2¬H6(g) = - 84,7 kJ/mol
ΔH0f O2(g) = 0 kJ/mol
ΔH0f CO2(g) = - 393,5 kJ/mol
ΔH0f H2O(g) = - 241,8 kJ/mol
ΔH0 reaksi
= {4 x ΔH0f CO2(g) + 6 x ΔH0f H2O(g) } - {2 x ΔH0f C2¬H6(g) + 7 x ΔH0f O2(g)}
= {4 x (- 393,5 ) + 6 x (- 241,8)} – {2 x (- 84,7) + 7 x (0)}
= {-1574 + (- 1450,8)} – {-169,4}
= - 3024,8 + 169,4
= 2855,4 kJ/mol
Reaksi b
C3H8(g) + 5O2(g)  3CO2(g) + 4H2O(l)
3CO2(g) + 4H2O(l)
Berdasarkan tabel data entalpi pemebntukan standar diatas, didapatkan :
ΔH0f C3H8(g) = - 104 kJ/mol
ΔH0f O2(g) = 0 kJ/mol
ΔH0f CO2(g) = - 393,5 kJ/mol
ΔH0f H2O(g) = - 241,8 kJ/mol
ΔH0 reaksi
= {4 x ΔH0f CO2(g) + 6 x ΔH0f H2O(g) } - {2 x ΔH0f C3¬H8(g) + 7 x ΔH0f O2(g)}
= {4 x (- 393,5 ) + 6 x (- 241,8)} – {2 x (- 104) + 7 x (0)}
= {-1574 + (- 1450,8)} – {-208}
= - 3024,8 + 208
= - 2816,8 kJ/mol
Soal 2
Diketahui beberapa entalpi pembentukan standar (ΔH0f).
ΔH0f C2H5OH = - 277,69 kJ/mol
ΔH0f CO2 = - 393,51 kJ/mol
ΔH0f H2O = - 241,82 kJ/mol
Entalpi pembakaran 92 gram etanol adalah . . . . (Mr etanol = 46)
A. +4830,64 kJ
B. +2469,58 kJ
C. - 2469,58 kJ
D. - 4830,64 kJ
E. – 9661,28 kJ
Pembahasan :
Langkah pertama adalah mebuat reaksi pembakaran etanol. Kalian ketahui bahwa etanol termasuk senyawa turunan hidrokarbon yang apabila mengalami reaksi pembakaran akan menghasilkan CO2 dan H2O.
Reaksi pembakaran etanol
C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
Yang perlu kalian ingat adalah bahwa nilai entalpi pemebentukan untuk molekul molekul diatomic bebas di alam / unsur bebas di alam selalu 0. Jadi walaupun pada soal diatas entalpi pembentukan O2 tidak diketahui, tetapi kita harus sudah mengerti bahwa entalpi pemebntukannnya selalu 0. Jadi jangan pusing ya…..
ΔH0 reaksi
= {2 x ΔH0f CO2(g) + 3 x ΔH0f H2O(g) } - {1 x ΔH0f C2H5OH(g) + 3 x ΔH0f O2(g)}
= {2 x (- 393,51 ) + 3 x (- 241,82)} – {1 x (- 277,69) + 3 x (0)}
= {- 787,02+ (- 725,46)} – {-277,69}
= - 1512,48 + 277,69
= - 1234,79 kJ/mol
Entalpi reaksi diatas adalah entalpi yang dihasilkan dari rekasi 1 mol etanol. Untuk mencari berapa perubahan entalpi reaksi 92 gram etanol adalah :
mol 92 gram etanol = 92 / 46 = 2 mol
ΔH0 reaksi = 2 mol x (- 1234,79 kJ/mol)
= - 2469,58 kJ
Jawaban : C
Soal 3
Pada pembakaran 1 mol benzene (C6H6) dilepaskan kalor sebesar 3.271 kJ pada suhu 250C tekanan 1 atm. Jika diketahui ΔH0f CO2 = - 394 kJ/mol dan ΔH0f H2O = - 286 kJ/mol, kalor pembentukan standar C6H6 adalah . . . . .
A. + 98 kJ/mol
B. + 49 kJ/mol
C. + 40 kJ/mol
D. – 49 kJ/mol
E. – 98 kJ/mol
Pembahasan :
Sekarang yang ditanya bukan kalor pembakaran benzene, tetapi kalor pembentukan standarnya. Langkah pertama yang harus kita lakukan tetap adalah mebuat reaksi pembakaran benzene 1 mol benzena :
C6H6 + 7,5O2  6CO2 + 3H2O ΔH0 reaksi = - 3.271 kJ
6CO2 + 3H2O ΔH0 reaksi = - 3.271 kJ
ΔH0 reaksi = {6 x ΔH0f CO2(g) + 3 x ΔH0f H2O(g) } - {1 x ΔH0f C6H6(g) + 7,5 x ΔH0f O2(g)}
- 3.271 kJ = {(6 x – 394) + (3 x – 286) } – { (1 x ΔH0f C6H6(g)) + (15x 0)}
- 3.271 kJ = {- 2364 + ( - 858)} - ΔH0f C6H6(g)
- 3.271 kJ = - 3222 kJ – 2 x ΔH0f C6H6(g)
ΔH0f C6H6 = - 3222 kJ + 3271 kJ
ΔH0f C6H6 = - 49 kJ/mol
Jawaban : D
Soal 4
Dikatahui sebuah cuplikan memiliki data sebagau berikut.
ΔH0f cuplikan = - 278,9 kJ/mol
ΔH0f CO2 = - 392,5 kJ/mol
ΔH0f H2O = - 286,9 kJ/mol
Cuplikan tersebut dibakar menghasilkan kalor sebesar 7.464,77 kJ. 2 mol CO2 dan 3 mol H2O. jika massa cuplikan 250,24 gram, berapakah Mr culikan?
Pembahasan :
Cuplikan ini pasti senyawa karbon karena hasil pembakarannya menghasilkan CO2 dan H2O. Kita tidak perlu membuat reaksinya sebenarnya, karena pada soal sudah diketahui jumlah mol CO2 dan H2O yang dihasilkan. Untuk O2 sebagai perekasi pembakar, jumlah mol nya juga tidak terlau penting karena harga entalpi pembentuan standarnya juga 0.
Massa cuplikan yang dibakar adalah = 250,24, yang jika dibakar menghasilkan kalor sebesar 7.464,77 kJ.
Langkah pertama yang harus kita lakukan adalah mencari berapa kalor pembakaran untuk 1 mol cuplikan berdasarkan data entalpi pembentukan standar zat yang diketahui.
ΔH0 reaksi
= {2 x ΔH0f CO2(g) + 3 x ΔH0f H2O(g) } - {1 x ΔH0f C2H5OH(g)}
= { 2 x - 392,5 + 3 x - 286,9} – {- 278,9}
= {- 785 – 573,8} + 278,9
= - 1358,8 + 278,9
= - 1.079,9 kJ/mol
ΔH0 reaksi = - 1.079,9 kJ/mol adalah untuk 1 mol cuplikan
Jika dihasilkan 7.464,77 kJ, maka jumlah mol cuplikan yang bereaksi adalah
= - 7.464,77 kJ/ - 1.079,9 kJ/mol = 4,14 mol
mol cuplikan = gr / Mr
Mr cuplikan = gr / mol = 250,24 / 4,14 = 60




Posting Komentar untuk "Cara Menentukan Perubahan Entalpi Reaksi Berdasarkan Tabel Entalpi Pembentukan Standar"